呼吸机相关肺炎研究进展(综述)
呼吸机相关肺炎(ventilator-associated pneumonia, VAP)是指应用机械通气治疗48小时,或撤停机械通气,拔除人工气道48小时内发生的肺实质炎症,X线检查可见肺部浸润性暗影,伴发热,白细胞增多,痰量或颜色的改变或分离出病原体。VAP是重症监护病房(intensive care unit, ICU)常见的院内感染,对于插管的患者VAP的发生率高达30%,且一旦发生,往往提示患者住院时间的延长,经济负担的加重,治疗难度的增加以及病死率的提高[1]。VAP的防治也逐渐成为危重病医学工作的重点。正确认识VAP相关研究动态有助于临床工作中对其开展更好的诊疗和防治。本文就这一方面的研究进展做一综述。1 流行病学
1.1 发病率及病死率
根据文献报道,不同时间不同地区不同人口特征的VAP发生率差异较大,但病死率均较高。Ibrahim等[2]进行的前瞻性研究,880例行机械通气的患者中,132例明确诊断为VAP,VAP病死率为45.5%,较未发生VAP的机械通气患者(32.2%)明显增高(p=0.004)。Arabi等[3]系统分析了发展中国家成年人VAP发生情况,VAP发病率范围为10-41.7/1000机械通气日,病死率高达16%-94%,与欧美国家的25%-50%不同[1]。另一项大样本量的回顾性研究入组了美洲地区9080位接受机械通气超过24小时的ICU住院病人,其中842人发生了VAP。未发生VAP的2243名机械通气患者作为对照组,VAP组和对照组的病死率分别为30.5%和30.4%,差别不具有统计学意义(p=0.713)。但是VAP患病组比对照组明显延长了机械通气时间、ICU住院时间以及总住院时间,同时还增加了约40000美元/人的住院花费[4]。Tejerina[5]等对来自20个国家361个ICU约2897名机械通气超过12小时的患者的前瞻性研究,439名患者(15%)发生了VAP,且VAP患者更易于合并慢性阻塞性肺病、误吸、败血症以及急性呼吸窘迫综合症等,病死率约38%,与未发生VAP的对照组相比,未明显增加(38.1% VS 37.9%, p=0.95)。
对于VAP的发生是否导致机械通气患者死亡率的增加,仍然存在争论。Melsen等[6]近期对VAP归因病死率进行meta分析:集中了52个试验研究,共17347名患者的分析结果提示VAP发生的相对危险度为1.27(95%CI=1.15-1.39),但仍存在较大异质性(12 statistic=69%),可能是由于试验设计、试验质控以及诊断方法的差异所致,需要进一步亚组分析。对于外伤和急性呼吸窘迫综合征的患者,VAP相对危险度分别为1.09(95%CI=0.87-1.37)和0.86(95%CI=0.72-1.04),且异质性均在允许范围,故尚无证据表明VAP增加了这部分患者的死亡风险。
1.2 病原菌
引起VAP的主要病原微生物为细菌,且多为混合感染。以革兰阴性杆菌为主,最常见铜绿假单胞菌,其次是肺炎克雷伯菌、大肠埃希菌、鲍曼/溶血不动杆菌、金黄色葡萄球菌、阴沟肠杆菌、表皮葡萄球菌、真菌等。病原学资料可因患者群体、所处地区、病房环境、诊断取材以及抗生素使用情况不同而有所差异[7]。
Weber等[8]将引起VAP与医院获得性肺炎(HAP)的菌种进行比较发现:VAP的菌种主要包括革兰氏阳性球菌(32%,其中苯唑西林敏感的金黄色葡萄球菌占9.25%,苯唑西林耐药的金黄色葡萄球菌占17.75%),革兰氏阴性杆菌(59.0%,其中铜绿假单胞菌占17.50%,嗜麦芽窄食单胞菌占6.75%,不动杆菌属7.75%),其他混杂菌种9.0%。未行机械通气的HAP患者的菌种主要有革兰氏阳性球菌(42.59%,其中苯唑西林敏感的金黄色葡萄球菌占13.33%,苯唑西林耐药的金黄色葡萄球菌占20.37%),革兰氏阴性杆菌(39.63%,其中铜绿假单胞菌占9.26%,嗜麦芽窄食单胞菌占1.11%,不动杆菌属3.33%),其他混杂菌种17.78%。可见VAP与HAP相比,苯唑西林耐药的金黄色葡萄球菌的感染机率大致相同,但是革兰氏阴性杆菌(包括铜绿 假单胞菌,嗜麦芽窄食单胞菌及不动杆菌)的感染机率更大。
依据机械通气时间长短,VAP也有早发性和晚发性之分。早发性VAP,即气管插管或人工气道建立不足5天,病原体主要来源于呼吸道定植的病原体,如肺炎链球菌、流感嗜血杆菌、甲氧西林敏感的金黄色葡萄球菌等,但部分早发性VAP的发生也可由多药耐药菌所致;晚发性VAP,即机械通气时间超过5天,尤其合并有先前抗生素用药史,以铜绿假单胞菌、肠杆菌属、不动杆菌或耐甲氧西林金黄色葡萄球菌(MRSA)为主,多表现为多药耐药性[9]。
多药耐药菌与VAP的相关性逐渐得到证实,最近的研究表明[10],超广谱β内酰胺酶、羟氨苄青霉素β内酰胺酶和金属β内酰胺酶的产生可能是病原菌获得多药耐药性的原因。
2 发病机制及危险因素
VAP的发病,可归纳为病原菌侵袭机会增多和宿主免疫防御机制减弱两方面的原因。病原菌侵袭机会增多的途径:如气管插管、气管切开所致呼吸道防御屏障的破坏,定植于口咽部病原体的误吸达远端支气管,呼吸机环路的污染以及医护人员所致的交叉感染等;以及宿主免疫防御机制减弱的因素,如全身免疫机能受损,胃肠道菌群移位,气囊上滞留物的移行,细菌生物被膜的形成,抗生素的滥用等,均增加了VAP的发生几率[11,12]。
Pawar等[13]对VAP发生的危险因素进行单变量分析统计,主要有急诊手术、慢性阻塞性肺病、重新插管、激素治疗,主动脉球囊反搏、肠内营养、气管造口、应激状态、年龄、APACHEⅡ评分、预防性抗生素治疗以及间歇性正压通气(IPPV)时间。多变量分析统计仅有IPPV时间(153.75 +/- 114.44 vs 19.65 +/- 7.99; p < 0.001) 和激素治疗(20% vs 0%; p < 0.001)为VAP的独立预测因素。Iribarren等[14]研究探讨了年龄、性别、APACHE评分、相关疾病的发生、入组时低血压、昏迷、住院时间、机械通气时间、急诊插管、再插管、先前使用过抗生素以及耐药菌的存在等因素是否增加了VAP的死亡风险。经多变量统计分析,鼻胃管的使用、ICU住院时间的延长以及性别为男性均与VAP死亡率增加有关。此外,Agbaht 等[15]进行了为期44个月的前瞻性研究,发现合并有菌血症的VAP患者,尤其是MRSA所致者,较未发生菌血症的VAP患者,死亡风险增加(HR =2.55, 95%CI=1.25-5.23, p=0.01)。对于多药耐药菌是否是影响VAP预后的危险因素,仍然没有定论。Depuydt等[16]研究发现多药耐药菌所致VAP引起的死亡风险增加,可以用宿主本身存在多种合并症以及VAP之前的多器官功能障碍来解释。
3 诊断
3.1 临床诊断
所有疑似VAP的患者均需进行病史问诊及体格检查,同时辅以必要的辅助检查。常用的VAP临床诊断标准为:胸部X线摄片提示新出现的或进展中的浸润性病灶;并结合机械通气48小时后出现发热、白细胞增多或减少、脓痰,3项临床表现中的任意2项,即可做出诊断。该方法简单易懂,但假阳性率较高。更完善的肺炎诊断标准需包括临床诊断及微生物诊断两方面的信息。推荐国家院内感染监控系统(NNIS)及临床肺部感染评分(CPIS)应用于肺炎的诊断。表1和表2分别详述了NNIS和CPIS对院内感染肺炎的诊断标准。插管的病人呼吸道通常有微生物的定植,所以如果气管分泌物有病原微生物的证据,但是缺乏临床表现,不可轻易诊断为VAP;另一方面,接受机械通气的患者,引起发热和肺部浸润还存在其他方面原因,如果仅凭临床诊断标准,会造成相当比例的误诊率[17]。Miller等[18]研究发现NNIS诊断标准和临床疑似病例接受支气管肺泡灌洗液定量培养对VAP诊断的准确性接近。当结合支气管肺泡灌洗结果作为诊断依据之一时,NNIS诊断的灵敏度可达84%,特异度69%。同样,CPIS诊断VAP的准确性,各文献报道差异较大,辅以可靠的下呼吸道标本采集及革兰氏染色,可提高诊断的准确性。
表1 NNIS肺炎临床诊断标准[18]

表2 CPIS肺炎临床诊断标准[19]
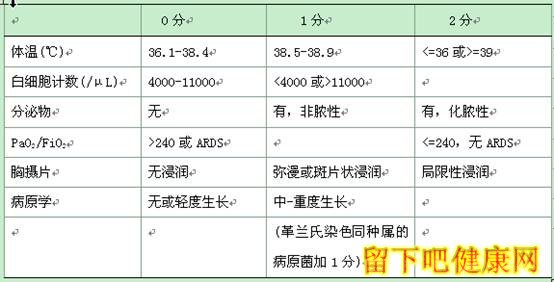
注:CPIS>6分符合肺炎诊断
3.2 病原学诊断
病原学诊断的建立,有助于指导抗生素的合理应用,防止经验性治疗所导致的抗生素的滥用。肺组织病理学提示炎性反应及与之相符的病原微生物是诊断VAP的“金标准”。但是肺组织标本通常难以获取,肺活检的接受性差,且抗菌药物的使用常会干扰结果的判读,临床较少用于VAP的诊断。故病原微生物诊断主要采用下呼吸道分泌物培养。
常用的标本采集方法有:气管内抽吸(endotracheal aspirate, ETA),支气管肺泡灌洗(bronchoalveolar lavage, BAL),防污染样本毛刷(protected specimen bruch, PSB)及保护性内镜导管取样(protected telescoping catheter, PTC)。优质样本的获取通常需要有创性的方法,如BAL、PSB等,非创伤性方法ETA由于易受口腔、咽喉等部位定植细菌的污染,特异性较差。目前公认度较高的用于VAP诊断的是BAL术和经纤维支气管镜PSB术采样定量培养。诊断标准如下:PSB术所获标本定量培养>=103cfu/ml;BLA术所获标本定量培养>=104cfu/ml;ETA术所获标本定量培养>=105cfu/ml;阳性的脓液或血培养结果[20,21]。
因气管内抽吸物定量培养(Quantitative Endotracheal Aspirate, QETA)的可操作性强,在用于VAP的诊断方面,QETA并不差于支气管肺泡灌洗液定量培养(Quantitative bronchoalveolar lavage, QBAL)[22]。但是Medford等[23]最近的研究发现,BAL的诊断正确率仍然高于ETA(49.3% vs 34.0%, p=0 .01),且灵敏度同样高于ETA(64.1% vs 42.6%, p =0 .0003)。但两种方法的特异度、阳性预测值和阴性预测值之间无明显差异。
可见,对于VAP的诊断,需要依赖临床和病原微生物两方面的诊断信息,几种微生物定量培养的方法诊断效能相近。血培养对肺炎诊断的特异性较差。细胞学资料,如炎症细胞及革兰氏染色,可能对疑似VAP患者的初始治疗决策有指导作用。C反应蛋白、原降钙素、及骨髓细胞可溶性触发受体等生物标记对VAP诊断有一定提示作用,但仍有待于进一步评价[24]。探索分子生物学方法,利用克隆文库及分子探针用于VAP病原微生物的诊断,也是很有前景的研究方向。
4 治疗
抗菌药物的正确选用是VAP治疗的关键。根据“塔拉戈纳策略”(The Tarragona Strategy )所达成的共识,对VAP的治疗,主张:(1)抗生素治疗应尽早开始;(2)基于局部状况和药代动力学的足够剂量和个体化用药;(3)选择具有良好肺穿透性的抗生素;(4)先用强力广谱抗生素,一旦获得可靠的细菌培养和药敏结果,及时换用针对性的窄谱抗生素,即降阶梯治疗(de-escalation therapy)[25]。
4.1 初始治疗
抗菌药物的准确选择有赖于病原学培养和药敏实验结果,在未获这些资料以前,应结合患者的发病时间、抗菌药物使用史及院内细菌的流行病学特点等进行经验性抗菌治疗。故临床上根据诊断的过程将VAP的用药大致分为两个阶段:病原菌尚不明确时的经验性治疗阶段和病原菌明确后的针对性治疗阶段。初始经验性治疗的开始时间与患者预后密切相关。 Iregui等[26]的研究发现,延迟初始抗菌治疗(诊断VAP后28.6+/-5.8h)与及时初始抗菌治疗(诊断VAP后12.5+/-4.2h)相比,明显增加了VAP病死率(69.7% VS 28.4%, p=0.001)。Luna等[27]入组了76名VAP患者,及时行初始抗菌治疗的患者(n=24)与延迟行初始抗菌治疗的患者(n=36)相比,病死率显著下降(29.2% vs 58.3%, p<0.05),余16人接受不适当的初始抗菌治疗,病死率高达75.0%,与前两者相比,差异均有统计学意义。
4.2 抗菌药物的合理应用
早发性及轻中度VAP患者常见病原体为肺炎链球菌、流感嗜血杆菌、MRSA、肠杆菌科细菌等,可选用第二代或非抗假单胞菌的头孢菌素类药物,或β内酰胺/β内酰胺酶抑制剂,或呼吸喹诺酮类,若β内酰胺类过敏,可选用克林霉素+氨曲南。
迟发性及重度VAP患者除上述病原体外还常见铜绿假单胞菌、MRSA、不动杆菌等多种耐药菌,建议使用抗假单胞菌喹诺酮类,或氨基糖苷类+下列药物之一:抗假单胞菌β内酰胺类/β内酰胺酶抑制剂(如哌拉西林/他唑巴坦、头孢哌酮/舒巴坦、头孢他定、头孢吡肟)、碳青霉烯类、单酰胺类。若怀疑为MRSA感染,可加用糖肽类抗生素。
对于患者存在多药耐药(MDR)菌感染危险因素(表3)的,由于常见的病原体为铜绿假单胞菌、产超广谱β内酰胺酶的肺炎克雷伯杆菌、产超广谱β内酰胺酶的大肠杆菌、不动杆菌属等细菌,初始经验性抗生素应选用抗假单胞菌头孢菌素(头孢吡肟、头孢他定)、碳青霉烯类(亚安培南、美罗培南),或β内酰胺类/β内酰胺酶抑制剂(哌拉西林/他唑巴坦),同时加用一种抗假单胞菌喹诺酮类(环丙沙星或左氧氟沙星),或氨基糖苷类(阿米卡星、庆大霉素,或妥布霉素);如怀疑MRSA,可加用利奈唑烷或万古霉素。
对于无MDR菌感染危险因素的患者,建议应用窄谱的抗生素治疗:头孢曲松、或氟喹诺酮、或氨苄西林/舒巴坦,或厄他培南[28]。
表3 MDR菌感染危险因素

4.3 降阶梯治疗
初始的经验性治疗,选用广谱抗菌药物,需覆盖所有的可能致病菌,但强效广谱抗菌药物联合治疗不宜长期使用,48-72小时后必须参考病原学结果和患者对治疗反应进行调整,改为相对窄谱的抗菌药物治疗,即为降阶梯治疗。根据细菌培养及药敏实验结果,由初始的经验性抗菌治疗,调整为针对性抗菌治疗,也是VAP最理想的治疗模式。可以有效避免治疗过度,减少抗菌药物的滥用,降低细菌耐药的机率,及缩短疗程[29]。
广谱抗菌药物缩减为窄谱是否影响了对VAP治疗的疗效,Joffe等[30]对这一问题进行了多中心的临床试验,740名疑似VAP患者均接受了初始经验性抗菌治疗,根据是否接受针对性抗菌治疗进行分组。对于细菌培养阳性的VAP患者(n=412),接受针对性抗菌治疗的患者(n=320)比未接受针对性抗菌治疗的患者(n=92),生存时间和脱离广谱抗菌药物的时间延长(14.5 vs 13.2, p=0.04);对于细菌培养阴性的VAP患者(n=327),需多次取样培养,直至明确病原微生物的存在,但接受针对性抗菌治疗的患者(n=230)比未接受针对性抗菌治疗的患者(n=97),同样有生存时间和脱离广谱抗菌药物的时间延长(15.9 vs 13.1, p<0.001),机械通气时间缩短(9.8 vs 14.7, p=0.03)。可见针对性抗菌治疗在减少用药的同时,并未对VAP的治疗产生不利影响。
关于抗菌治疗的持续时间,Chastre等[31]验证了降阶梯治疗短程疗法治疗VAP的安全性。排除致病菌为非发酵类革兰氏阴性菌。8天和15天抗菌治疗组在病死率、机械通气时间、ICU住院时间等方面均无显著差别。但是对于铜绿假单胞菌或不动杆菌所引起的VAP,仅接受8天短程疗法,疾病易复发。故建议对于临床工作中有效的抗菌治疗,疗程可缩短为8天,但是对于感染持续存在或病原菌为MDR菌者,疗程可延长至15天。对于临床表现疑似VAP,但是72小时PSB或BAL采样培养结果为阴性的患者,如伴有症状的好转,可以停止抗菌治疗[32]。
5 预防
对VAP的预防,主要分为两个方面:以循证临床实践指南为指导的预防措施和以装置技术改进为基础的预防措施。
5.1 循证临床实践指南[33](evidence-based practice guidelines , EBPG)
EBPG的制定,结合了美国胸科学会(the American Thoracic Society)和美国传染病学会(the Infectious Diseases Society of America)对VAP预防的建议,同时还参考了健康改善协会(Institute for Healthcare Improvement, IHI)制定的呼吸机治疗组套的相关内容,主要措施有半卧位的体位,减少镇静剂的使用、预防消化性溃疡的发生、加强口腔护理与严格无菌操作。
5.1.1 半卧位
半卧位的体位可使胃液反流、口咽部细菌定植和误吸的发生减少,同时,还能降低VAP发生的危险。推荐角度为30-45度。但是由于前期工作研究样本有限,且仅为单中心的研究结果,其结论的可信性尚需进一步研究。Van Nieuwenhoven等[34]将221例VAP患者,112例纳入仰卧45度组,109例纳入仰卧10度组,两组间的VAP发生率相近,没有显著差异。
5.1.2 减少镇静剂的使用
由于镇静剂可减弱患者的吞咽及咳嗽反射,易发生误吸,从而引起肺部感染,故机械通气的患者应尽可能减少镇静剂的剂量和镇静时间。最近的一项研究表明[35]未行镇静治疗的机械通气患者,比接受间断镇静治疗的患者,脱机时间延长(13.8+/-11.0 d vs 9.6+/-10.0 d, p=0.019),ICU住院时间缩短(HR 1.86, 95% CI 1.05-3.23; p=0.0316)。
5.1.3预防应激性溃疡
临床常用H2受体拮抗剂和质子泵抑制剂来预防应激性溃疡。早期的观点认为,这些药物使胃液PH值升高,增加了胃内革兰氏阴性菌的定植,VAP发生风险也相应增加。故欲采用对胃液PH没有影响的胃粘膜保护剂代替抑酸剂。新近的观点则认为使用胃粘膜保护剂、抑酸剂,与不用任何预防溃疡的药物相比,对VAP发病率的影响,差异不具有统计学意义[36]。
5.1.4 加强口腔护理
随着机械通气的实施,口咽部革兰氏阴性肠杆菌属和假单胞菌属的细菌定植增加。常规的口腔护理(包括牙齿清洁、口腔清洁、吸痰和吸痰管道的清洗及更换),可以有效减少口咽部细菌的定植,降低VAP的发生率。Meta分析[37]将几种口腔去污措施进行比较,结果提示,口腔护理时局部加用洗必肽,比常规口腔护理,显著降低了VAP的发生(RR 0.56, 95%CI 0.39-0.81);而口服抗生素未明显减少VAP的发生(RR 0.69, 95%CI 0.41-1.18)。
5.1.5 严格无菌操作
医护人员的手上常存在短暂的病原微生物寄植,故医护人员在诊治每位患者前后均需仔细洗手。戴手套和口罩也可有效预防交叉感染。但目前医护人员洗手的依从性较低,需注意改进。
5.2 技术及装置调整
5.2.1 声门下分泌物引流
气管插管患者的声门下与气管导管的气囊之间的间隙常有严重污染的积液存在,细菌浓度可达108-1010cfu/ml,当气囊内压力低于20cmH2O时,分泌物可漏入或误吸入下呼吸道,导致VAP的发生。故采用声门下可吸引气管导管间断或持续吸引该分泌物,有助于减少VAP的发生[38]。需要注意持续吸引易造成局部支气管粘膜的损伤。
5.2.2 呼吸环路及相关设备的管理
以往的研究认为呼吸环路污染与VAP密切相关,因而环路至少每天更换一次。但近来研究发现减少环路的更换频率不会影响病原微生物在环路中的定植,也不会影响VAP的发生率。至于呼吸机环路的最长安全使用时间仍有待于进一步研究,目前的证据多倾向于每周更换一次。无创通气、经口气管插管等措施较有创通气、经鼻气管插管可减少VAP的发生。湿化器是呼吸机环路中的重要部件,因人工气道丧失了上呼吸道加热加湿和过滤细菌的功能。传统的加热式湿化器(heated humidification system, HHS)可以代替人工气道的加热加湿功能,热湿交换器(heat and moisture exchange)还具有过滤作用,而且环路内相对干燥,不利于病原微生物定植,从而使VAP的发生率降低。关于这两种湿化系统的比较,没有发现明显差异[39]。另外,闭合吸引导管是环路内连接负压的导管,可有效清除气管导管和气管内的分泌物,与闭合导管不同,开放吸引导管易受到周围环境的影响,但是尚没有充分证据说明闭合吸引导管优于开放式[40]。
5.2.3 新型气管导管的研制
抗菌气管导管(主要指表面包被磺胺嘧啶银和洗必泰)的应用旨在减少气管导管、呼吸机环路及气管内病原菌的定植。由于银这种材料无毒、抗菌谱广,能减少导管表面细菌的粘附,进而减少生物膜的形成,已有试验证明表面覆银的气管插管能显著减少VAP的发生[41]。Berra L等[42]的研究同样发现磺胺嘧啶银-聚氨酯复合材料气管导管体外能有效抑制铜绿假单胞菌生物膜的形成,动物体内能有效抑制细菌在呼吸道的定植。此外,大多数的气管插管气囊为高容低压(high-volume, low-pressure,HVLP),新一代超薄型的气囊采用聚氨酯为材料,充气后与气管贴合紧密,能有效防止分泌物漏入下呼吸道[43],由高容低压状态向低容低压转变,也是新型气囊的研制方向。
6 小结
接受机械通气的患者,约1/3会发生VAP,病死率高。临床医生应重视VAP的诊断,尤其是下呼吸道分泌物培养明确病原学诊断。早期正确的经验性抗生素应用,以及根据病原学诊断结果及患者对治疗的反应,采取降阶梯治疗并维持适当时间,能够改善患者预后,减少耐药的发生,最优化治疗效果。对于VAP的预防,从某种程度上说,其重要性不亚于VAP的治疗,更应得到广大医护人员的重视。
参考文献:
[1] Safdar N, Dezfulian C, Collard HR, et al. Clinical and economic consequences of ventilator-associated pneumonia: a systematic review[J]. Crit Care Med 2005, 33(10):2184-2193.
[2] Ibrahim EH, Tracy L, Hill C, et al. The occurrence of ventilator-associated pneumonia in a community hospital: risk factors and clinical outcomes[J]. Chest, 2001, 120(2):555-561.
[3] Arabi Y, Al-Shirawi N, Memish Z, et al. Ventilator-associated pneumonia in adults in developing countries: a systematic review[J]. Int J Infect Dis. 2008, 12(5):505-512.
[4] Rello J, Ollendorf DA, Oster G, et al. Epidemiology and outcomes of ventilator-associated pneumonia in a large US Database[J]. Chest 2002, 122(6):2115-2121.
[5] Tejerina E, Frutos-Vivar F, Restrepo MI, et al. Incidence, risk factors, and outcome of ventilator-associated pueumonia[J]. J Crit Care 2006, 21(1):56-65.
[6] Melsen WG, Rovers MM, Bonten MJ. Ventilator-associated pneumonia and mortality: a systematic review of observational studies[J]. Crit Care Med. 2009, 37(10):2709-2718.
[7] Bhattacharya S, Mondal AS. Clinical microbiology in the intensive care unit: strategic and operational characteristics. Indian J Med Microbiol. 2010, 28(1):5-10.
[8] Weber DJ, Rutala WA, Sickbert-Bennett EE, et al. Microbiology of ventilator-associated pneumonia compared with that of hospital-acquired pneumonia[J]. Infect Control Hosp Epidemiol. 2007, 28(7):825-831.
[9] Giantsou E, Liratzopoulos N, Efraimidou E, et al. Both early-onset and late-onset ventilator-associated pneumonia are caused mainly by potentially multiresistant bacteria[J]. Intensive Care Med. 2005,31(11):1488-1494.
[10] Joseph NM, Sistla S, Dutta TK, et al. Ventilator-associated pneumonia in a tertiary care hospital in India: role of multi-drug resistant pathogens[J]. J Infect Dev Ctries. 2010, 4(4):218-225.
[11] Diaz E, Rodriguez A, Rello J. Ventilator-associated pneumonia: issues related to the artificial airway[J]. Respir Care. 2005,50(7):900-906.
[12] Japanese Respiratory Society. Ventilator-associated pneumonia[J]. Respirology. 2009 Nov;14 Suppl 2:S51-8.
[13] Pawar M, Mehta Y, Khurana P, et al. Ventilator-associated pneumonia: Incidence, risk factors, outcome, and microbiology. J Cardiothorac Vasc Anesth. 2003, 17(1):22-28.
[14] Iribarren B O, Aranda T J, Dorn H L, et al. Mortality risk factors in ventilator associated pneumonia[J]. Rev Chilena Infectol. 2009, 26(3):227-232.
[15] Agbaht K, Diaz E, Muñoz E, et al. Bacteremia in patients with ventilator-associated pneumonia is associated with increased mortality: A study comparing bacteremic vs. nonbacteremic ventilator-associated pneumonia[J]. Crit Care Med. 2007, 35(9):2064-2070.
[16] Depuydt PO, Vandijck DM, Bekaert MA, et al. Determinants and impact of multidrug antibiotic resistance in pathogens causing ventilator-associated-pneumonia[J]. Crit Care. 2008, 12(6):R142.
[17] Porzecanski I, Bowton DL. Diagnosis and treatment of ventilator-associated pneumonia[J]. Chest. 2006, 130(2):597-604.
[18] Miller PR, Johnson JC 3rd, Karchmer T, et al. National nosocomial infection surveillance system: from benchmark to bedside in trauma patients[J]. J Trauma.2006,60(1):98-103.
[19] Luyt CE, Chastre J, Fagon JY. Value of the clinical pulmonary infection score for the identification and management of ventilator-associated pneumonia[J]. Intensive Care Med. 2004,30(5):844-852.
[20] Torres A, Fàbregas N, Ewig S, et al. Sampling methods for ventilator-associated pneumonia: validation using different histologic and microbiological references[J]. Crit Care Med. 2000, 28(8):2799-2804
[21] Hunter J, Annadurai S, Rothwell M. Diagnosis, management and prevention of ventilator-associated pneumonia in the UK[J]. Eur J Anaesthesiol. 2007, 24(11):971-977.
[22] Canadian Critical Care Trials Group. A randomized trial of diagnostic techniques for ventilator-associated pneumonia[J]. N Engl J Med. 2006, 355(25):2619-2630.
[23] Medford AR, Husain SA, Turki HM, et al. Diagnosis of ventilator-associated pneumonia[J]. J Crit Care. 2009, 24(3):473.e1-6.
[24] Rea-Neto A, Youssef NC, Tuche F, et al. Diagnosis of ventilator-associated pneumonia: a systematic review of the literature[J]. Crit Care. 2008, 12(2):R56.
[25] Sandiumenge A, Diaz E, Bodi M, et al. Therapy of ventilator-associated pneumonia A patient-based approach based on the ten roles of The Tarragona Strategy[J]. Intensive Care Med. 2003, 29(6):876-883.
[26] Iregui M, Ward S, Sherman G, et al. Clinical importance of delays in the initiation of appropriate antibiotic treatment for ventilator-associated pneumonia[J]. Chest. 2002,122(1):262-268.
[27] Luna CM, Aruj P, Niederman MS, et al. Appropriateness and delay to initiate therapy in ventilator-associated pneumonia[J]. Eur Respir J. 2006, 27(1):158-164.
[28] American Thoracic Society, Infectious Diseases Society of America. Guidelines for the management of adults with hospital-acquired, ventilator-associated, and healthcare-associated pneumonia. Am J Respir Crit Care Med 2005, 171(4):388–416.
[29] Diaz E, Muñoz E, Agbaht K, et al. Management of ventilator-associated pneumonia caused by multiresistant bacteria[J]. Curr Opin Crit Care. 2007, 13(1):45-50.
[30] Joffe AR, Muscedere J, Marshall JC, et al. The safety of targeted antibiotic therapy for ventilator-associated pneumonia: a multicenter observational study[J]. J Crit Care. 2008, 23(1):82-90.
[31] Chastre J, Wolff M, Fagon JY, et al. Comparison of 8 vs 15 days of antibiotic therapy for ventilator-associated pneumonia in adults: a randomized trial. JAMA. 2003,290(19):2588-2598.
[32] Kollef MH, Kollef KE. Antibiotic utilization and outcomes for patients with clinically suspected ventilator-associated pneumonia and negative quantitative BAL culture results. Chest. 2005,128(4): 2706-2713.
[33] Efrati S, Deutsch I, Antonelli M, et al. Ventilator-associated pneumonia: current status and future recommendations[J]. J Clin Monit Comput. 2010, 24(2):161-168.
[34] Van Nieuwenhoven CA, Vandenbroucke-Grauls C, van Tiel FH, et al. Feasibility and effects of the semirecumbent position to prevent ventilator-associated pneumonia: a randomized study[J]. Crit Care Med. 2006, 34(2): 396–402.
[35] Strøm T, Martinussen T, Toft P. A protocol of no sedation for critically ill patients receiving mechanical ventilation: a randomised trial[J]. Lancet. 2010, 375(9713):475-480.
[36] Kallet RH, Quinn TE. The gastrointestinal tract and ventilator-associated pneumonia[J]. Respir Care. 2005, 50(7):910-921.
[37] Chan EY, Ruest A, Meade MO, et al. Oral decontamination for prevention of pneumonia in mechanically ventilated adults: systematic review and meta-analysis[J]. BMJ. 2007, 334(7599):889 .
[38] Bouza E, Perez MJ, Munoz P, et al. Continuous aspiration of subglottic secretions in the prevention of ventilator-associated pneumonia in the postoperative period of major heart surgery[J]. Chest. 2008, 134(5): 938–946.
[39] Kelly M, Gillies D, Todd DA, et al. Heated humidification versus heat and moisture exchangers for ventilated adults and children[J]. Cochrane Database Syst Rev. 2010, 4:CD004711.
[40] Jongerden IP, Rovers MM, Grypdonck MH, et al. Open and closed endotracheal suction systems in mechanically ventilated intensive care patients: a meta-analysis[J]. Crit Care Med. 2007, 35(1):260-270.
[41] Kollef MH, Afessa B, Anzueto A, et al. Silvercoated endotracheal tubes and incidence of ventilator-associated pneumonia: the NASCENT randomized trial. JAMA. 2008, 300(7): 805–813.
[42] Berra L, Curto F, Li Bassi G, et al. Antimicrobial-coated endotracheal tubes: an experimental study[J]. Intensive Care Med. 2008, 34(6):1020-1029.
[43] Lorente L, Lecuona M, Jimenez A, et al. Influence of an endotracheal tube with polyurethane cuff and subglottic secretion drainage on pneumonia[J]. Am J Respir Crit Care Med. 2007, 176(11): 1079–1083.