经桡动脉路径治疗冠脉复杂病变
近年来经桡动脉途径的冠脉动脉介入治疗(TRI)愈来愈受医患双方的欢迎,在某些中心已占到PCI总数的绝大部分。与经股动脉途径的PCI相比,TRI后患者即可恢复下床活动,无体位限制,且局部出血发生率较股动脉途径明显下降,因此颇受医患双方的欢迎。但是TRI也存在一些问题,如桡动脉较股动脉细小,血管穿刺要求较高,易痉挛,所使用的器械较股动脉途径偏小,血管径路常存在严重扭曲,导管支撑力下降等问题容易使TRI失败。本文拟结合我们近年来的临床经验,就经桡动脉途径处理复杂冠脉病变的一些常见困难做一系统回顾,并探讨一些新的技术与技巧,以期对临床工作有所裨益。
病例1. 经桡动脉途径三球囊对吻处理三分叉病变
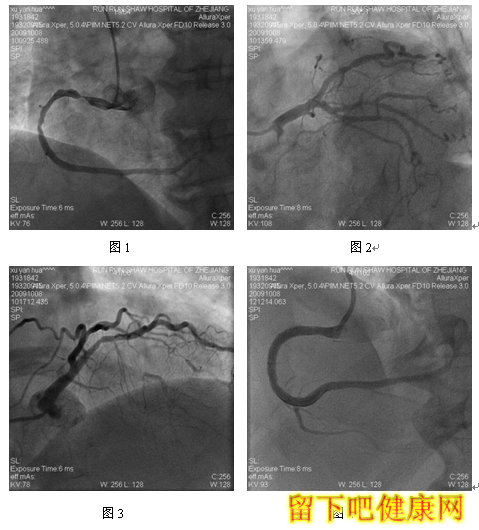
患者,男,76岁,因“反复胸闷气急乏力1年余,加重4月”入院。既往有高血压病史20年,阵发性房颤病史15年。EKG:房颤伴ST-T改变。运动平板试验:阳性。心超示:左室肥厚,EF 76%。冠脉造影结果如下(图1-4)
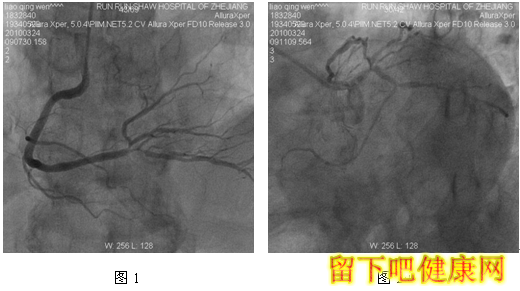
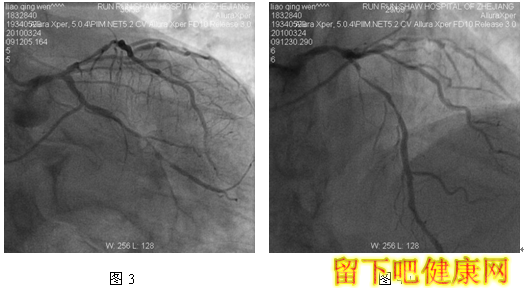
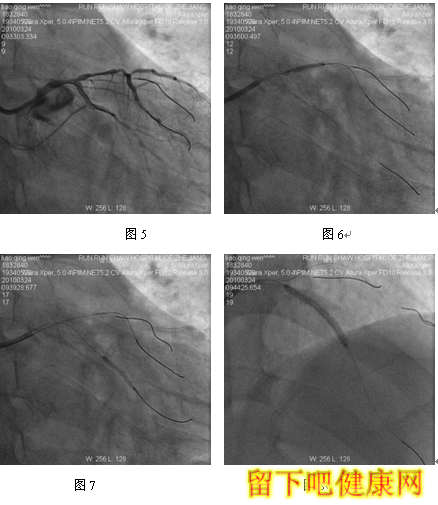
经与家属沟通,拟先对左冠血管行PCI治疗,选用6F EBU 3.5 guiding导管到左冠状动脉开口处, 选用Runthrough钢丝进入LAD远端,选用Fielder钢丝进入中间支,选BMW钢丝进入LCX远端(图5)。选用Ryujinplus2.0*20mm球囊对前降支中段、近段及回旋支中远段病变行预扩张(图6-7)。前降支近中段病变处植入Cypher Select3.0*33mm药物支架(图8),回旋支中远段病变处植入Cypher Select2.5*28mm药物支架(图9),左主干开口至前降支近段植入,与前一支架串联(图10),支架植入后造影结果提示对中间支和回旋支开口有挤压(图11-12),如果行三球囊对吻,可能取得更满意的结果。将中间支与LAD交换钢丝,经对侧桡动脉将5F EBU 3.5 guiding导管送到左冠状动脉开口处,选用PILOT50钢丝进入回旋支(图13),送入Quantum2.25*15mm球囊至回旋支,经6F EBU指引导管送入Kongou3.5*15mm球囊至前降支,Quantum2.5*15mm球囊至中间支,分别高压扩张后,行三球囊最终Kissing Ballon术(图14)(图15)。最后造影结果显示支架膨胀良好,各分支充分开放(图16-18)
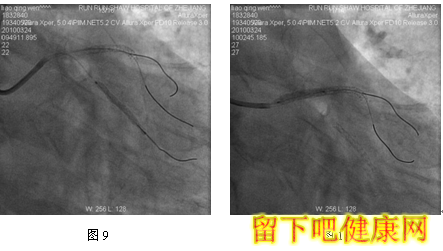
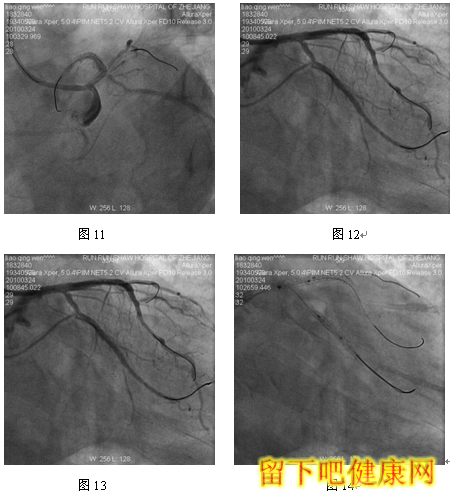
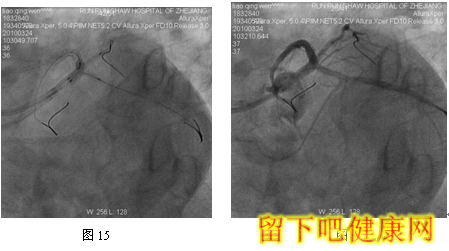
经桡动脉途径行PCI时,指引导管内腔最大匹配为6F,因此,分叉病变需要双支架/多支架/多球囊技术时经桡动脉途径存在一定局限性。6F指引导管下无法完成的三球囊对吻。在本例患者中,我们采用6F+5F/4F双指引导管技术,顺利完成三球囊对吻,很好地克服了经桡动脉途径的局限性。
病例2. 左主干病变经桡动脉途径6F GC step-kissing支架术
患者,女性,56岁,因“反复劳力性胸闷1年余,加重3天”入院。心血管危险因素:高血压、脂质代谢异常。心电图:左室肥大伴劳损改变。运动试验:阳性(广泛前壁)。心脏超声:正常左室内径,收缩功能正常。冠脉造影结果见图1-4。面对这样一个患者我们首先需要考虑的是血运重建策略的选择。由于该患者系多支病变且涉及前三叉,因此可以考虑CABG,但是患者拒绝,因此接下去我们需要考虑的是PCI策略:是单支架还是双支架?假如双支架那采取何种术式?由于该患者左主干很粗大,直径显著大于两个分支血管,因此我们考虑采用Kissing/V-stenting技术。介入治疗过程如下:
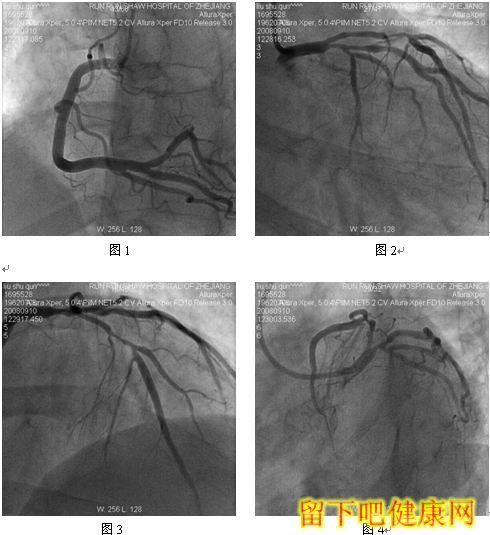
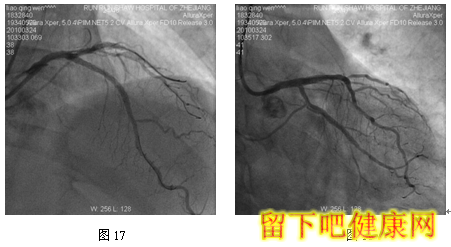
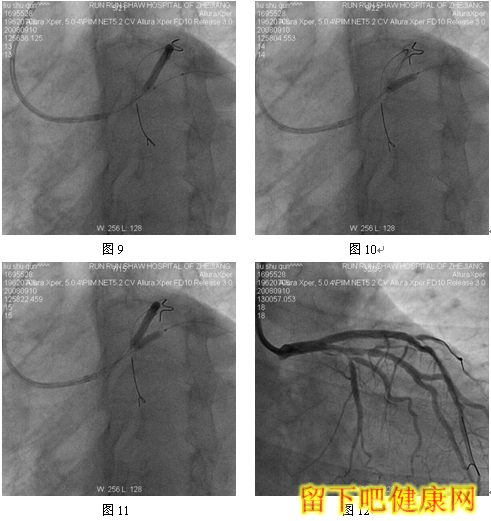
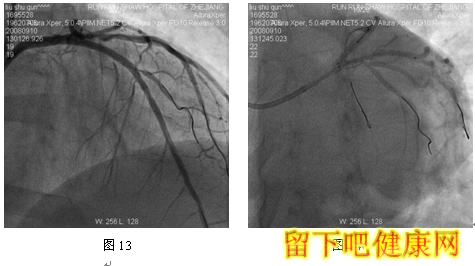
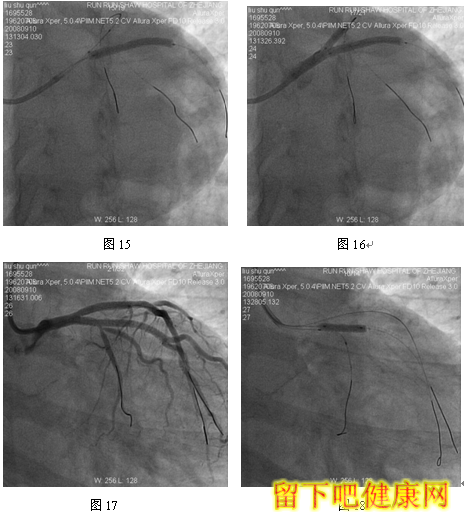
经6F指引导管送入BMW钢丝测量LAD病变长度,然后进入LAD远端(图5),选用Asahi Soft钢丝进入第一对角支远端进行保护,选用Run Through导丝测量LCX病变长度,然后进入回旋支远端(图6)。选用Partner 3.0×36mm支架放置于LM-LAD(图7),NC Sprinter 3.0×15mm球囊放置于LM-LCX保护(图8),LM-LAD 直接支架,高压释放(图9),LM-LCX保护球囊高压释放(图10),LM-LAD支架球囊/LM-LCX保护球囊实施第一次对吻(图11),LM-LAD支架球囊/LM-LCX保护球囊对吻后造影结果(图12、13)。选用Firebird 3.0×33mm支架定位于LM-LCX,NC Sprinter 3.0×15mm球囊放置于LM-LAD保护(图14),LM-LCX支架高压释放(图15),LM-LCX支架球囊/ LM-LAD 保护球囊实施第二次对吻(图16),LM-LCX支架球囊/ LM-LAD 保护球囊对吻后造影结果(图17)。完成LCX-OM分叉及LAD-D分叉Kissing Ballon术后(图18-24),拟采用高压球囊对Kissing支架再次高压成形。选用Quantum 3.25×12mm高压球囊对LAD支架行后扩张(图25),LM-LCX高压球囊(NC Sprinter 3.0×15mm)/ LM-LAD 高压球囊(Quantum 3.25×12mm)准确定位后分别高压,10ATM最终对吻(图26-28),最后造影结果(图29-30)。

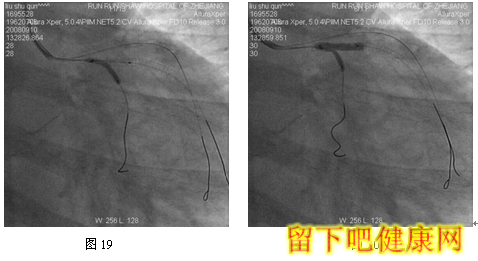
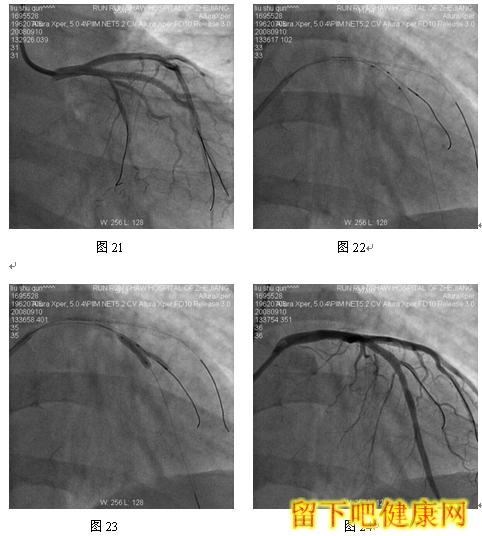
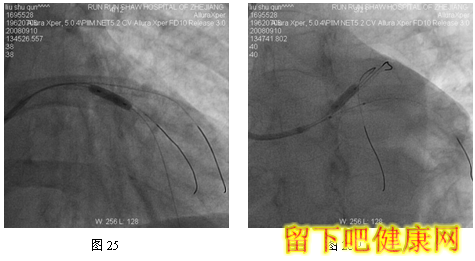
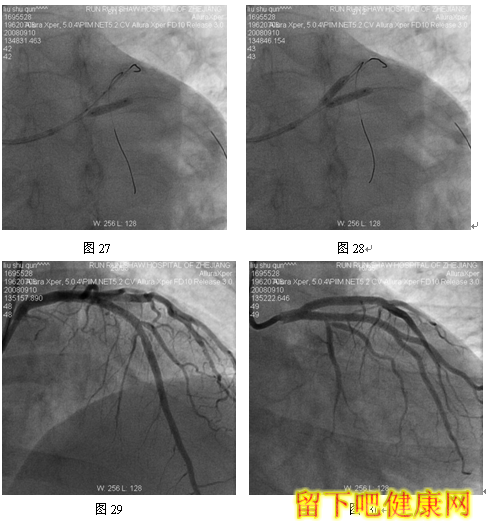
目前在6F指引导管下,采用STEP技术可以安全、顺利完成各种多支架,如简化CRUSH /CULLOTE支架技术。但有学者认为6F指引导管TRI的最后技术障碍——不能完成V和KISSING支架技术。在STEP技术启发下,我们开发出经6F指引导管TRI V和KISSING支架技术——Step-Kissing支架技术。该患者LM很粗大并且LAD和LCX差不多粗大,LM直径=2/3(LAD+LCX)直径,因此适合行V-/Kissing-支架技术。该例患者,我们经桡动脉途径6F指引导管,采用球囊保护技术顺利实现V-、K-支架技术。此外,6F指引导管能实现多钢丝、多分支保护技术。
病例3. IVUS指导下、逆行导丝技术处理前降支完全闭塞病变
患者,男性,78岁 ,因“反复活动后胸痛1年余,加重2周 ”入院。既往有高血压病史5年 。入院时查心电图示窦性心律、完全性右束支传导阻滞。心超检查LVEF 69%,结构大小无殊 。血肌钙蛋白(-)。 入院后予以负荷波利维和阿司匹林治疗后予以冠脉造影检查,选用的是右侧桡动脉径路,6F血管鞘。造影发现:右冠近端95%狭窄,左主干正常,前降支第1对角支处完全闭塞(图1-3)。对该患者,引起此次症状的罪犯血管应该是右冠脉的病变,但目前尚无心肌坏死的依据,不存在急诊干预的情况。处理右冠脉病变可能会遇到无复流,慢复流,虽然几率不高,但由于同时存在前降支的完全闭塞,一旦发生,手术的风险将明显升高。于是我们首先选择尝试处理前降支CTO病变,但由于闭塞起始段位于前降支对角支分叉处,经过反复尝试导丝不能正确穿刺闭塞段起点。术中病人出现胸痛,放弃前降支PCI,对右冠实行了PCI。为防止可能出现的慢血流现象,干预前给予了冠脉内注射欣维宁、植入IABP处理,右冠PCI过程平稳(图4)。
1月后再次对前降支行PCI术。同样采取的是右侧桡动脉径路,6F EBU 3.5指引导管,经IVUS检查可以清楚地看到前降支闭塞段的起点部位,这样导丝就能方便地识别正确的穿刺点,并经IVUS证实(图5-6)。可惜后来导丝未能到达远端血管真腔,考虑到RCA经间隔支到前降支的侧枝循环较好(7-8),于是我们选择了逆行导丝技术。
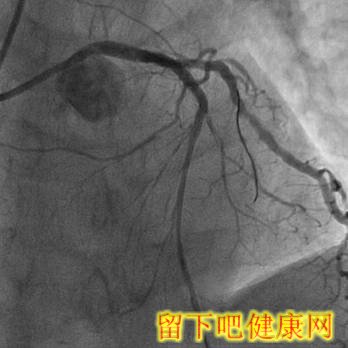
图12
讨论:
一、入路困难
成功的桡动脉穿刺是进行TRI的首要关键操作。桡动脉穿刺前首先要评估患者的桡尺动脉之间的侧枝循环。穿刺前可和患者适当交流以减轻紧张情绪。对于桡动脉细弱患者可用利多卡因混合100ug/ml 浓度的硝酸甘油表浅麻醉以增强桡动脉的搏动。桡动脉穿刺成功后鞘管内注入肝素5000IU可以减少桡动脉闭塞的风险。
桡动脉易发生痉挛。究其原因,术者的操作水平、年龄和女性是容易发生桡动脉痉挛的主要因素。克服桡动脉痉挛重在预防,如患者的安静、充分的麻醉、避免反复穿刺。长的、带亲水涂层的桡动脉鞘,亲水超滑导丝可以减少桡动脉痉挛的发生。但即使是最熟练的术者,也不可能完全避免,特别是年轻女性,存在血管严重扭曲,冠脉开口异位需要反复操作导管等。绝大数情况下在发生痉挛后采取适当的方法后还是可以完成手术操作的。鞘管内注射异搏定等血管扩张药物可以使用,但有时效果可能不佳,而且需要等待较长的时间。另外,注意动脉内注射异搏定时血管的刺激性较大,可以回抽血与药液混合后推注以减少刺激。痉挛后有时左冠造影导管到位相对更加困难,可改用4F造影导管或指引导管,以及亲水的5F EBU指引导管。发生桡动脉痉挛后TRI时推送6F指引导管往往在前臂部位受阻,此时切忌粗暴,否则易造成血管的夹层,穿孔。此时要完成TRI选用5F指引导管是一个比较不错的选择,但如果该患者是分支病变就不能在5F指引导管内完成常规球囊的对吻。我们在临床实践中灵活运用5 in 6F技术较好的解决了这个问题。就是在6F指引导管内套上稍长的5F直头指引导管或者猪尾导管往往顺利通过受阻处,5F猪尾导管比较经济。此时进入的6F指引导管还对破裂、夹层的前臂血管有压迫止血的作用。直接换用长血管鞘也是一个选择,但有时会导致拔鞘困难。另外要注意,如果推送指引导管困难要注意排除导丝进入小分支的可能,如副肱动脉,此时可以顺利完成造影,但推送指引导管很困难,即使采用5 in 6F法,此时应当进行及时的前臂血管造影。
严重的血管扭曲往往使导管不能顺利到位,从而使TRI失败。在造影时选用亲水导丝有助于通过扭曲的血管,而且可以使某些“loop”拉直。但也要注意某些少见的“loop”上有很多分支发出把“loop”固定,此时不宜尝试拉直血管,可更换对侧桡动脉。有时亲水泥鳅导丝也很难通过扭曲血管,可尝试PTCA导丝通过。对于桡动脉扭曲病例有时可采用外部压迫改变血管走形的方法使导丝顺利通过。锁骨下动脉或头臂干迂曲时导丝有时容易通过,但在尝试深呼吸,转头等动作后6F指引导管还难于通过时,在6F指引导管内套上5F直头指引导管或者猪尾导管是不错的选择。
血管存在严重迂曲时操作导管应在导丝帮助下完成,不要一个方向过度旋转造影导管或指引导管,以免引起导管打折。注意导管打折后不要往后拉,如果在近心端大血管内打折可以试着往前送,在上肢血管内打折可以嘱助手固定上肢,然后在透视下小心反方向旋转导管以解折。导丝支撑力差导管难于到达窦底可换用普通J型导丝或加硬导丝。对于严重的血管扭曲PCI时建议左冠采用EBU指引导管,一来到位后支撑力好,二来EBU指引导管相对容易到位。我们曾对数例食管后右锁骨下动脉的患者TRI时采用EBU指引导管最后均取得了成功。当然对于食管后右锁骨下动脉的患者如果反复尝试导管不能到位,此时改穿左侧桡动脉是比较明智的选择。
二、复杂支架技术改良
大号指引导管使用的受限是TRI的不足之处。尽管在某些特定情况下选用 7F,甚至8F的指引导管在经桡动脉途径的PCI中是可行的,但对于绝大多数患者来说最理想的指引导管为6F,特别是对复杂分叉病变。6F指引导管的内径可达0.070~0.071in, 可以满足球囊切割、球囊对吻,≤1.50mm直径磨头的旋磨、抽吸导管的使用等。由于不能同时将2枚支架放置在6F指引导管中,因此不能经6F指引导管完成标准的Crush、V 或SKS操作,但6F的大腔指引导管中可以容纳支架和小外径球囊,因此可以完成T支架术 、step crush术、 balloon crush 、modified balloon crush 、 DK crush、reverse crush术及Culottes支架术。有时对于三分叉病变而需要三球囊同时对吻时可另穿刺对侧桡动脉,选用4F、5F和6F双指引导管便可完成三球囊、四球囊的同时对吻,甚至是三、四个非顺应性球囊的同时对吻。
我们对V, SKS支架术进行了改良,适合经桡动脉6F指引导管下完成,称为Step kissing stents技术,具体操作如下:常规送2根软导丝到达两分支血管远端 ,选用与较小分支血管参考直径相近的球囊分别预扩张两分支血管,再退出球囊。先送入支架至相对较小分支血管的远端,再送入原预扩球囊至另外一支血管,调整位置行支架-球囊的第一次对吻扩张。退出2个球囊后,再先送入第二个支架至相对较大血管的远端,依次再送入原预扩球囊至另外一支血管,调整位置行支架-球囊的第二次对吻扩张,这样完成了两个支架的置入。
三、TRI时强支撑处理
指引导管足够的支撑力是决定TRI成功的关键因素。左冠状动脉以EBU、XB、VL、BL等导管最为常用。如对支撑要求不高或为左主干开口病变,则可选择JL、Ikari L、Q-curve指引导管。如要求强支撑时,特别是处理回旋支病变时,AL可以提供非常好的支撑力。绝大多数的右冠状动脉PCI选用JR4.0或JR3.5,少数情况下可选用AL0.75、AL1.0、XBRCA,AR等,新近我们发现用于处理左冠的导管,用在右冠常规开口和向上的羊角型开口,可以提供非常好的支撑力。另外,最近我们使用一些6.5F和7.5F无鞘指引导管,可能在进一步减少血管损伤方面会有所作为,因为,7.5F无鞘指引导管的外径相当于6F血管鞘的外径,而内腔超过7F指引导管,而且该指引导管的外表面清水涂层比所有现有指引导管优秀,应该能一定程度减少血管痉挛的发生。
如需要超强支撑可在6F指引导管中插入5F直头指引导管,即所谓母子指引导管技术,也称5 in 6 技术。5 in 6 技术在TRI起了很重要的作用,可以在不改变原指引导管及导丝的前提下大大增加原PCI系统的支撑力。TRI时系统的支撑力强弱不光与指引导管相关,还与导丝,球囊,支架的配合操作密切相关。
四、结束语
TRI相对以往熟悉的股动脉途径来说会遇到各种各样的困难,但只要小心,耐心,有心,绝大多数复杂冠脉病变可以得到顺利解决,相信TRI的成功率会随着术者经验的不断积累和新器械的不断推动下大幅提高,桡动脉路径会成为越来越多术者的第一选择。