血小板不同活化途径在阿司匹林或氯吡格雷作用下的反应特点
关键词: 血小板,阿司匹林,氯吡格雷,即时检验
摘要:目的 探讨阿司匹林和氯吡格雷抑制血小板COX-1途径和P2Y12受体活化的特点及两途径之间的交互关系。方法 20例健康男性志愿者随机平均分为两组,分别服用阿司匹林(100mg/d)和氯吡格雷(75mg/d)连续7天。并在服药和停药后第1、3、5、7天分别应用新型床旁即时检测技术(血栓弹力图、血小板功能分析仪)和流式细胞仪观察血小板的抑制情况。结果 在服药前后,氯吡格雷组的胶原-肾上腺素激活的闭孔时间(CEPI-CT)和胶原-腺苷二磷酸闭孔时间(CADP-CT)的变化均有统计学意义(F=27.2, 25.3,p<0.05),阿司匹林组仅CEPI-CT的变化有统计学意义(F=36.7,p<0.05)。两受试组CEPI-CT和CADP-CT的相关性均有统计学意义(r=0.855,0.786, p<0.05)。服药后阿司匹林组血小板COX-1途径抑制率增高有统计学意义(F=35.1, p<0.05),并与ADP诱导活化的抑制相关(r=0.869, p<0.05),氯吡格雷组ADP活化的P2Y12受体抑制率增高(F=24.8, p<0.05),AA诱导的活化未COX-1未受到有效抑制(F=1.85, p>0.05)。两组在服药后CD62p表达显著降低(氯吡格雷:F=28.7,p<0.05;阿司匹林:F=20.7, p<0.05)。结论 AA诱导的COX-1途径活化与P2Y12受体活化可能存在交互作用,床旁即时检验有助于快速了解血小板功能状态,为有效的联合用药监测提供依据。
Responses of different platelet activation pathways from Aspirin/Clopidogrel administration : New Point-of-care tests
Li Jian1, Cao Jian2, Wang Chengbin3, Wang Hua-Zhong3, Jia Guan-zhou3, Mo Ya-ming3. Cong Yu-long3.
1 Clinical Laboratory Center, Hainan Branch of Chinese PLA General Hospital, Sanya 57200;
2 First Department of Geriatric Cardiology, 3 Clinical Laboratory, Chinese PLA General Hospital, Beijing 100853, China
Corresponding Author: Cong Yu-Long, email:hemthm@yahoo.com.cn
Abstract Objective To investigate the inhibition profiles of aspirin and clopidogrel on COX-1 and P2Y12 receptor, and potential interaction between them. Method 20 healthy male volunteers were admitted and divide into two groups, which take clopidogrel (75-mg loading dose and maintenance) or aspirin (100-mg loading dose and maintenance) in consecutive 7days. Platelet inhibition (%), CEPI-CT / CADP-CT, and CD62p were observed on the 1st, 3rd, 5th and 7th day after medicine intake and withdraw. Results Both CEPI-CT and CADP-CT changed significantly (F=27.2 and 25.3, p<0.05) after clopidogrel use, only CEPI-CT changed statistically after aspirin administration (F=36.7, p<0.05). Inhibition on COX-1 induced by arachidonic acid (inhibitionAA) increased statistically (F=35.1, p<0.05) after aspirin intake. In clopidogrel group, it was P2Y12 inhibitionincreased statistically (F=24.8, p<0.05), but not inhibitionAA(F=1.85, p>0.05). CD62p expression decreased in both groups (clopidogrel: F=28.7, p<0.05; aspirin: F=20.7, p<0.05) after intake. Conclusions COX-1 activation may interact with P2Y12 receptors in clinical settings and POCT in platelet function helps to monitor in dual-therapy informatively.
Keywords: Platelet, Acetylsalicylic Acid, Clopidogrel, Point-of-care test
血小板活化作为血栓形成中主要的始动因素在正常止血和病理凝血过程中发挥着重要作用,抗血小板药物的应用也日益成为预防心肌梗死、脑卒中等心脑血管疾病和介入治疗的焦点;特别是所谓“药物抵抗”现象受到广泛关注以来,血小板功能监测备受瞩目。为此,本文应用床旁即时检验系统血小板功能分析仪PFA-100和血栓弹力图两种新方法结合流式细胞术,对健康个体进行了阿司匹林和氯吡格雷作用下的血小板功能分析,以期发现花生四烯酸诱导的COX-1途径和二磷酸腺苷活化的P2Y12受体受抑制的反应特征。
1 对象和方法
1.1 研究对象
本院医生和工勤人员20例,入选标准:健康成年男性志愿者(23-35岁),红细胞压积在30%-50%之间,血小板计数100-30109/L,CRP<0.8mg/dL。排除标准:出血性疾病史;消化道溃疡病史;既往严重高血压史(收缩压200mmHg或舒张压≥120mmHg);妊娠期妇女,高度怀疑主动脉夹层或动脉瘤,肝肾功能障碍;接受口服华法林抗凝治疗。随机分为两组,10例服用阿司匹林肠溶片(拜阿司匹灵片,德国拜耳制药),连续7天,每天100mg,另外10例服用氯吡格雷片(波立维,法国赛诺菲公司),连续7天,75mg/天,每次均监督服药。分别在服药前,服药和停药后第1、3、5、7天的抽血送检。除一例服用阿司匹林者有轻度牙龈出血外,未见其他副作用。
1.2 方法
检测当天下午采集受试者静脉血,使用内含肝素锂和0.109mol/L枸橼酸钠(1:9)的试管(BD公司,美国)抗凝,血小板功能分析在采血后三小时内全部完成。
分别使用胶原-肾上腺素反应杯(collagen/epinephrine,记为CEPI)和胶原-腺苷二磷酸(collagen/adenosine-diphosphate,CADP)反应杯在PFA-100 (DADE Berhing,德国)中检测受试者抗凝标本,记录血小板黏附和聚集时堵塞微孔所需的时间(closure time,CT)。CEPI-CT和CADP-CT的参考范围分别为(82– 150)s 和(62–100)s。
利用血栓弹力图仪Thrombelastograph 5000 (TEG, Haemonetics公司,美国)分别测定最大振幅(Maximum Amplitude, MA)、纤维蛋白凝集力(MAA)、腺苷二磷酸(ADP)和花生四烯酸(Arachidonic Acid, AA)诱导的血小板凝集力(MAAA和MAADP),从而计算出全血条件下AA(或ADP)途径的抑制率[(1-(MA-MAAA/ADP)/(MA-MAA))x100%]。各主要指标的参考范围分别为R:2-8min、K:1-3min、Angle:55-78度以及MA:51-69mm。
使用配套试剂在FACSCalibur流式细胞仪(BD公司,美国)上测定血小板活化标志物CD62p的活性。
上述三种方法根据制造商建议和目前研究的通行办法,使用未服抗血小板制剂的健康人血标本进行质控,通过后进行测试。
为了消除炎症反应[1]和血液流变学对研究结果的影响,服药前后分别测定了受试者的白细胞计数(WBC)、C反应蛋白(CRP)和全血粘度。白细胞计数在XT-4000i血细胞分析仪(Sysmex公司,日本)上使用原厂配套试剂完成,CRP在BN II特种蛋白分析仪(Siemens公司,德国)使用原厂Hs CRP试剂测定,全血粘度在SA-6000全自动血液流变分析仪(赛科希德公司,北京)上检测[31] 。在四个切变率(1-200 S-1)下男性全血粘度的参考区间(mPa.s)分别为:17.63-21.35、8.31-9.95、5.18-5.94和3.53-4.65,每天开机后使用原厂标准油作为质控物检测,质控通过后再检测标本。
1.3 统计方法
实验数据以X±SD表示,组内均值比较采用配对t检验,服药前后各参数的变化趋势采用一般线性模型(General Linearity Model)进行重复测量分析(GLM)重复测试方法分析,以闭孔时间和抑制率的相关性分别采用Spearman和Person统计(由于前者存在超出上限的高值),软件分析应用SPSS 12程序为统计工具,P <0.05时认为具有统计学意义。
2 结果
2.1 血液学基本参数调查
受试对象的白细胞、C反应蛋白和全血粘度在服药前后的差异无统计学意义(见表1)。
表1 受试前/后各组白细胞、C-反应蛋白和血液粘度的比较(X±SD)
组别
WBC
CRP
全血粘度(mPa.S -1)
(x109/L)
(mg/dL)
1 (s-1)
5 (s-1)
30 (s-1)
200(s-1)
阿司匹林组
#p#分页标题#e#服药前
服药7天
6.3±1.2
5.8±1.4
<0.3
<0.3
18.7±2.3
19.4±2.5
8.0±2.2
8.5±2.7
4.4±1.5
5.1±1.8
3.5±1.1
3.2±1.3
氯吡格雷组
服药前
服药7天
4.9±1.3
5.2±1.5
<0.3
<0.3
19.3±2.8
18.2±2.1
8.5±2.1
7.8±2.1
4.5±1.7
4.8±1.3
3.1±0.8
3.3±1.2
2.2 CEPI-CT和CADP-CT
阿司匹林组服药三天后,CEPI-CT全部超过检测上限300s(见图1),停药第七天仍处于较高水平,CEPI-CT随时间变化有统计学意义(F=36.7, p<0.05);CADP-CT未超出参考区间,变化不显著(F=2.12, p>0.05)。氯吡格雷组CEPI-CT和CADP-CT均有显著增高(F=27.2, F=25.3,p<0.05),两者间存在相关性(r=0.855, p<0.05)。阿司匹林组两参数也存在相关性(r=0.786, p<0.05);两组CEPI-CT之间同样存在相关性(r=0.759, p<0.05)。
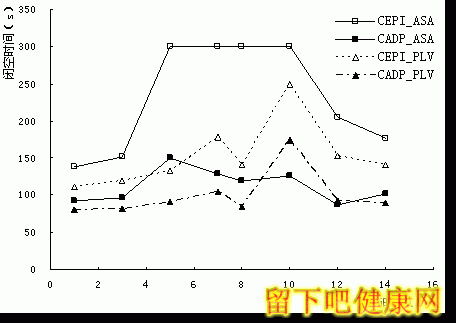
图1 服用阿司匹林或氯吡格雷时受试组CEPI-CT和CADP-CT的变化趋势。
(ASA:阿司匹林, PLV:氯吡格雷)
2.3 AA和ADP诱导聚集受抑制的情况(图2)
阿司匹林组服药后AA诱导聚集的抑制率显著增高,停药后迅速下降(F=35.1, p<0.05);ADP活化途径在服药后变化与AA诱导存在相关性(r=0.869,p<0.05)[33] 。氯吡格雷组ADP诱导的聚集率服药后逐渐减低(F=24.8, p<0.05),AA诱导的聚集未见显著变化(F=1.85, p>0.05)。
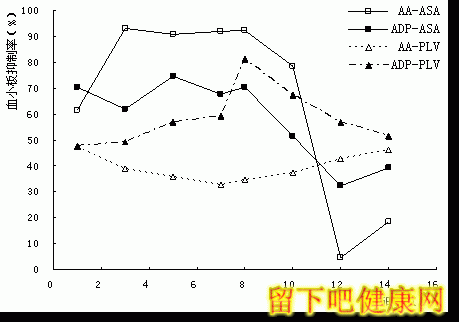
图2 服用阿司匹林和氯吡格雷时受试组血小板抑制率的变化趋势
2.4 CD62p的表达特征
服药后,氯吡格雷组(F=28.7,p<0.05)和阿司匹林组(F=20.7,p<0.05) CD62p的表达均出现统计学意义的变化,服药7天后CD62p降低50%以上。
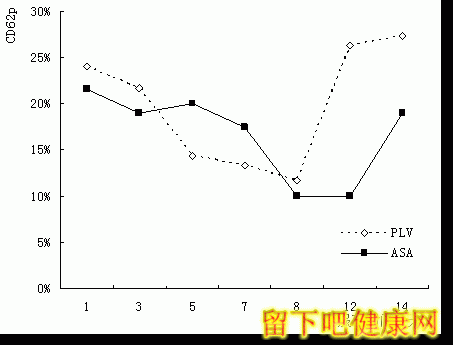
图3 两受试组CD62p在服药前后的变化
3 讨论
大量前瞻性研究表明阿司匹林抑制血小板活性的实际疗效需要监测。作为临床监测血小板功能的主要手段,公认的标准方法—光学法血小板聚集率检测受到诸多分析前影响因素(比如采血方法、抗凝种类、药物干扰和难于标准化等)和方法学本身(血浆提取和血小板数目等)的限制,重复性偏差,对临床治疗的指导作用受限。此外,血小板释放的活性物质进一步诱导活化而放大聚集反应,或者由于糖蛋白受体的脱敏反应导致血小板反应性降低而减弱聚集。这些干扰的不可预知性使临床迫切地需要更为理想、方便的检测技术[2]。PFA-100, TEG,VerifyNow和Sonoclot等床旁型即时检验(POCT)设备的异军突起,为血小板功能监测和指导临床治疗带来了新的曙光。
PFA-100血小板功能分析仪的闭孔时间综合性地反映了包括聚集在内的多种血小板功能[3],患者服用阿司匹林时通常表现为CEPI-CT延长,而CADP-CT反应不大[4、5]。本研究除证实该结论外,还发现CADP-CT在用药和停药后有小幅波动,提示其他途径(如ADP活化)可能受到阿司匹林的间接影响。有观点认为PFA100对氯吡格雷等P2Y12受体拮抗剂的疗效检测似乎不很敏感[6、7],对此,有必要从检测原理和研究设计的角度加以理解,CEPI-CT或CADP-CT反映的是血小板活化过程中COX-1或P2Y12途径的活化,也包括一些相关因素的作用:比如在高切变率条件下红细胞比积和血液粘度的差异作用,胶原的参与受到vWF水平的影响以及血小板水平的高低等[8、9],如果实验设计未平衡这些因素,将造成结论上的偏差。近来,Raman等[10]在研究氯吡格雷抑制的迟发作用时发现PFA100是能够检出氯吡格雷长期效应的。由于血小板抑制与CRP的潜在相关性[11],本研究也测定了WBC和CRP等参数用于排除相关因素的影响。
PlateletMapping®技术使血栓弹力图在监测凝血功能的基础上,增加了对抗血小板药物疗效的检测。阿司匹林组服药后AA活化抑制率显著增高,提示100mg阿司匹林能够有效抑制健康个体的COX-1活化,与PFA-100相似的是,ADP活化的抑制也出现小幅波动。由于血小板活化时伴随着ADP的释放,ADP继而又激活血小板,所以存在着两个途径活化偶联的可能性,两者之间是否存在统计学相关性仍需增加样本量进一步研究。氯吡格雷组在服药后存在COX-1抑制的减低趋势,也提示这种关联的存在;同时,也说明如果同时服用阿司匹林,可同步有效抑制两个主要的活化方式,为联合用药的决策提供了依据。此外,大部分耐受患者表现为稳定的血小板高活性特点[12],不因用药时间和总量而变化;如果使用灵敏度较高的方法发现血小板高反应性,则有助于进行个体化治疗。氯吡格雷抑制血小板活化的这些特点为围手术期抗栓提供了思路和依据,延伸性研究有助于选择介入术的最佳时机。
氯吡格雷作为ADP受体P2Y12的拮抗剂抑制了CD62P的表达[13], 虽然本研究显示服用氯吡格雷后CD62表达减低,但是笔者认为,通用的ADP浓度(20 umol/L)远远高于激活聚集所需的浓度(5 umol/L), Geiger等使用5 umol/L ADP刺激血小板观察CD62P,就没有发现安慰剂与氯吡格雷之间差异[14]。高浓度ADP还将产生非嘌呤诱导的次级反应,使血小板反应不具有特异性,PLUTO-Stroke试验也提示CD62P可能不适于评价氯吡格雷对血小板的抑制[15]。
虽然不同POCT技术之间未必存在数据上的量化关系,但是两者之间的符合率和受试者的表现趋势是一致的,这是推广即时检验技术的基础;在利用快速便捷优势的同时,使用者也应充分了解各方法的潜在影响因素,杜绝片面结论的形成。本研究应用两种新型床旁检测技术探索了血小板不同活化途径在阿司匹林或氯吡格雷作用下的反应特点,发现不同途径之间可能存在偶联关系或交互作用,这种关系的存在一方面为联合用药提供了佐证,另一方面也为研究血小板活化提出了新的思路。
致谢:衷心感谢李蕊女士和西门子公司提供支持。
参考文献
1 Cheng T, Mathews KA, Abrams-Ogg AC, et al.. Relationship between assays of inflammation and coagulation: A novel interpretation of the canine activated clotting time. Can J Vet Res, 2009, 73(2): 97-102.
2 Tantry, U. S, Gurbel A. Assessment of oral antithrombotic therapy by platelet function testing. Nat Rev Cardiol, 2011, 8(10): 572-579.
3 李健 从玉隆. 血小板功能分析与止凝血检验进展.中国医疗器械信息, 2006,12(6):1-6
4,Homoncik M, Jilma B, Hergovich N, et al. Monitoring of aspirin (ASA) pharmacodynamics with the platelet function analyzer PFA-100. Thromb Haemost, 2000, 83: 316–321.
5 Feuring M, Schultz A, Losel R, et al. Monitoring acetylsalicylic acid effects with the platelet function analyzer PFA-100. Semin Thromb Hemost, 2005, 31: 411–415.
6 Golanski J, Pluta J, Baraniak J, et al. Limited usefulness of the PFA-100 for the monitoring of ADP receptor antagonists—in vitro experience. Clin Chem Lab Med, 2004, 42:25–29.
7 Hezard N, Metz D, Nazeyrollas P, et al. PFA-100 and flow cytometry: can they challenge aggregometry to assess antiplatelet agents, other than GPIIbIIIa blockers, in coronary angioplasty? Thromb Res, 2002, 108:43–47.
8 Favalaro E. J, Face, D, Henniker, A. Use of a novel platelet function analyzer (PFA-100) with a high sensitivity to disturbances in von Willebrand factor to screen for von Willebrand’s disease and other disorders. Am J Hematol, 1999, 62:165–174.
9 Israels S. J, Cheang T, McMillan–Ward, E. M, et al. Comparison of the PFA-100® platelet function analyzer and the template bleeding time in evaluation of patients with a clinical bleeding history. Blood, 1999, 94(suppl 1):452a.
10 Raman S, Jilma B. Time lag in platelet function inhibition by clopidogrel in stroke patients as measured by PFA-100. J Thromb Haemost, 2004, 2: 2278–2279.
11 Saltzman AJ, Mehran R, Hooper WC,et al. The relative effects of abciximab and tirofiban on platelet inhibition and C-reactive protein during coronary intervention. J Invasive Cardiol, 2010, 22(1): 2-6.
12 Jaitner J, Stegherr J, Morath T, et al. Stability of the high on-treatment platelet reactivity phenotype over time in clopidogrel -treated patients. Thromb Haemost, 2011, 105(1): 107-112.
13 Hermann A, Rauch BH, Braun M, et al. Platelet CD40 ligand (CD40L) -subcellular localization, regulation of expression, and inhibition by clopidogrel. Platelets, 2001, 12:74–82.
14 J Geiger, L Teichmann, R Grossmann, et al. Monitoring of Clopidogrel Action: Comparison of Methods. Clinical Chemistry, 2005, 51(6): 957–965
15 Serebruany VL, Malinin AI, Ziai W et al. Effects of clopidogrel and aspirin in combination versus aspirin alone on platelet activation and major receptor expression in patients after recent ischemic stroke: for the Plavix Use for Treatment of Stroke (PLUTO-Stroke) trial. Stroke, 2005, 36(10): 2289-2292.